Brasileiro que estudou rendesivir critica OMS por não recomendar remédio
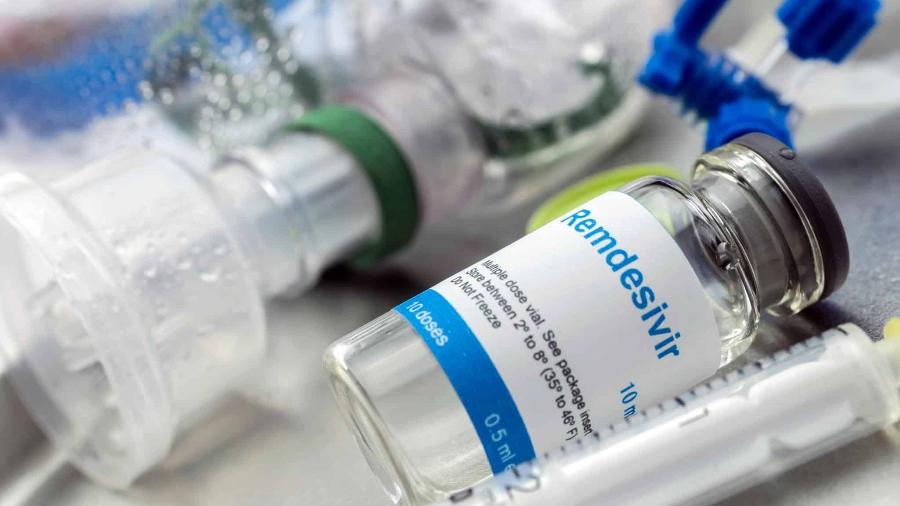
O médico brasileiro André Kalil, que participou de estudo nos Estados Unidos sobre a aplicação do antiviral rendesivir em pacientes com covid-19, criticou hoje a OMS (Organização Mundial de Saúde), que confirmara a sua ineficácia para o tratamento contra a doença.
"A decisão de não recomendar da OMS em função de estudos de baixo nível científico... Infelizmente, quando se misturam estudos de baixo rigor científico com alto rigor científico, fica muito difícil avaliar os benefícios", disse Kalil, em entrevista à CNN Brasil. "Eu realmente não entendo essa 'não recomendação' da OMS. Eu acho equivocada, baseada em uma ciência que não tem rigor como foi dada aqui nos EUA. Eu acho, inclusive, antiético não se administrar o rendesivir em pacientes graves", acrescentou, em seguida.
Em novembro do ano passado, a OMS se posicionou contra o uso do medicamento no tratamento de pacientes hospitalizados com covid-19, por não demonstrar, segundo a organização, resultados robustos em estudos clínicos.
Um artigo publicado no British Medical Journal, um painel de especialistas da organização afirmou que o uso do remédio não é recomendado pois não há evidência de que ele aumente a chance de sobrevivência ou diminua o risco de ventilação mecânica.
Também no ano passado, a FDA —agência que regula drogas e medicamentos nos Estados Unidos— concedeu o registro para o medicamento, autorizando, assim, seu uso em pacientes hospitalizados com coronavírus. Já a Anvisa (Agência Nacional de Vigilância Sanitária) anunciou a liberação do medicamento no Brasil hoje.
À CNN, Kalil apresentou três pontos positivos no uso do medicamento contra a covid-19, a partir do estudo do qual participou:
- A aceleração clínica, ou seja, uma recuperação em torno de 50% mais rápida. Os pacientes, segundo ele, saíram do hospital de 5 a 7 dias mais cedo do que os pacientes que não receberam a medicação;
- O rendesivir reduziu o óbito em torno de 45% nessas duas primeiras semanas [de internação], e em 70% em pacientes graves;
- Houve uma redução de 40% de necessidade de intubação dos pacientes.
O médico brasileiro também alertou que, apesar dos bons resultados, o remédio é apenas para pacientes em estados mais grave, e não para prevenção.
"É uma medicação que tem efeitos benéficos, mas essa medicação é só para pacientes que estão hospitalizados, com covid-19, numa situação mais grave. Ela não é uma medicação para ser usada como prevenção. É uma medicação para tratamento de casos mais grave", reforçou ele.
Já o infectologista e professor da Unesp, Carlos Fortaleza, em entrevista à Globo News, lembrou que rendesivir "não é uma droga milagrosa" e que estudos não encontraram o efeito desejado.
"O rendesivir não é uma droga milagrosa. Há uma série de estudos, principalmente em casos graves, que foram conduzidos na Europa, na China e nos EUA que não encontraram o efeito desejado no rendesivir. Por isso, a OMS se mantém relutante em considerar que ele seja uma medicação, de fato, de primeira linha contra a covid-19."
Anvisa libera medicamento
A Anvisa anunciou hoje o registro do primeiro medicamento que terá em bula a recomendação para o tratamento da covid-19, o rendesivir —desenvolvido inicialmente para combater o Ebola.
De acordo com o gerente-geral de Medicamentos da Anvisa, Gustavo Mendes, apesar de haver muita discussão sobre o uso do medicamento, a decisão foi tomada com base em "qualidade, segurança e eficácia". O medicamento aprovado é indicado em casos mais graves da doença, nos quais os pacientes se encontram hospitalizados e intubados. (Assista ao vídeo abaixo)
Outros estudos
Junto com o rendesivir, a Anvisa também autorizou o estudo clínico de fase 3 com o medicamento ruxolitinibe em pacientes com tempestade de citocinas associada à covid-19. O medicamento é utilizado no tratamento da mielofibrose, um tipo de câncer que ataca as células responsáveis pela produção de sangue na medula óssea.
A autorização foi dada a partir de pedido feito pela empresa Novartis Biociências S.A. De acordo com o protocolo clínico do estudo pretende-se incluir 60 pacientes brasileiros com tempestade de citocinas associada à Covid-19.












ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.