Anvisa pede que médicos e pacientes notifiquem efeitos adversos das vacinas
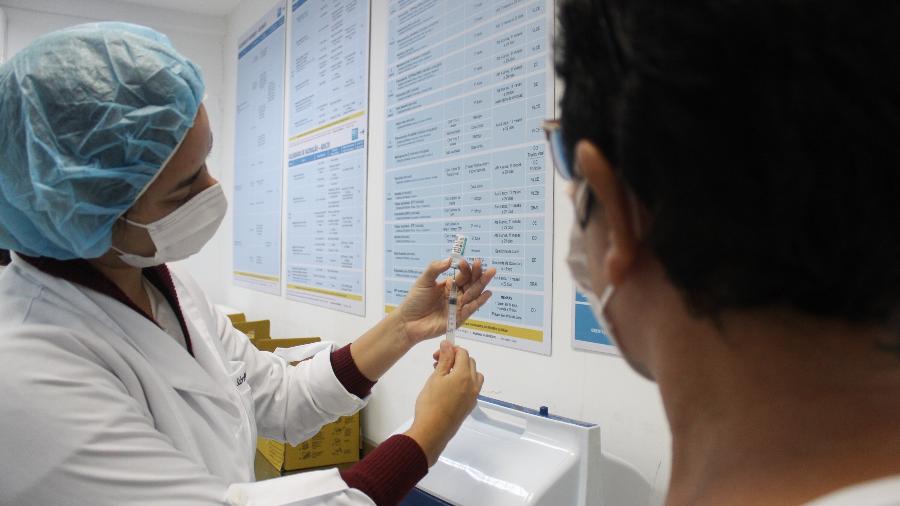
Em audiência pública da Comissão de Fiscalização Financeira e Controle da Câmara dos Deputados realizada hoje, a segunda-diretora da Agência Nacional de Vigilância Sanitária (Anvisa), Meiruze Sousa Freitas, apelou para que médicos e pacientes notifiquem eventos adversos das vacinas contra a covid-19.
Ela apontou para a importância de realizar estudos pós-vacinação, em especial para monitorar os efeitos das vacinas sobre as novas variantes do novo coronavírus, que têm maior potencial de transmissão da doença.
A segunda-diretora da Anvisa ponderou que, nos primeiros resultados recebidos pela Anvisa, os efeitos adversos são de linha média e moderada. "Estes dados ainda estão sendo compilados, mas nenhum resultado aponta para suspensão de vacina", observou.
As notificações de queixas técnicas ou de eventos adversos podem levar à adoção de medidas restritivas, caso necessário. As notificações podem ser encaminhadas no portal da Anvisa e podem relatar problemas no produto, como qualidade irregular, ou no paciente.
Outra preocupação dos estudos pós-vacinação é analisar a efetividade das vacinas em grupos específicos da população, que não foram estudados nos testes clínicos.
Falsificação
A Anvisa também alertou para casos de falsificação, em que se utilizou vacina da gripe no lugar da vacina contra Covid. A agência também atuou com a Polícia Federal para investigar venda de vacinas no Rio de Janeiro.
"Eram estelionatários dizendo que tinham a vacina. Mas chegando ao local, eram apenas promessas falsas de venda de vacina", explicou Meiruze.
Para evitar a falsificação, a Anvisa alerta para a necessidade de devolução dos frascos vazios que tenham o rótulo das vacinas.
Sputnik V
Meiruze notou que o Brasil foi o País que mais aprovou vacinas por sua agência regulatória, com cinco vacinas avaliadas.
"Nossa vantagem é que participamos do desenvolvimento clínico das vacinas desde o começo, por isso conseguimos conhecer melhor a plataforma das vacinas. Isso favorece uma avaliação mais séria, seja no momento do registro, seja no momento da autorização de uso emergencial", comentou.
Ela informou que haverá reunião nesta quinta-feira com estados do Nordeste para ajustar a entrega de informações sobre a Sputnik V.
A vacina só poderá entrar no Brasil após assinatura de termo de compromisso com cada estado responsável pela importação. Também há limitações de quantidade para monitorar a vacina, com a realização de um estudo de efetividade.
A Anvisa autorizou a importação especial e temporária da Sputnik V, que é registrada na Rússia e tem autorização de uso emergencial na Índia e na Argentina. Na avalição inicial para a vacinação, a Sputnik V foi reprovada porque não tinha relatório clínico da autoridade sanitária.
"Havia falta de informações para que se pudesse fazer a avaliação", explicou Meiruze.
A importação da Sputnik V foi autorizada com restrições de público-alvo porque o relatório não trazia todas as informações necessárias para autorização. A vacina não pode ser utilizada em pessoas com comorbidades, não podem ser gestantes ou lactantes. Somente adultos acima de 18 anos e menores de 60 anos podem tomar a Sputnik V.
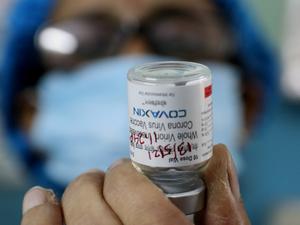
Covaxin e CanSino
A Covaxin também tem condicionantes de aplicação. Inicialmente, 4 milhões de doses da Covaxin serão importadas pelo Ministério da Saúde, que também precisa entregar mais informações e assinar termo de compromisso.
A Anvisa ainda aguarda informações adicionais do laboratório para autorização da vacina CanSino, que já tem autorização no Chile, México e Argentina. "Está próxima a decisão da Anvisa", avisou. No portal da Anvisa é possível acessar um painel sobre a análise das vacinas, mostrando o que está pendente.
A Anvisa também publica painel de informações de estudos clínicos. Já foram autorizados 83 estudos e 28 estão em análise.
Aquisição por empresas
Na audiência pública, o deputado General Peternelli (PSL-SP) apontou para a necessidade de permitir que o sistema privado de saúde também comercialize as vacinas contra Covid-19.
"Vejo que o setor público ainda não comprou algumas vacinas autorizadas pela Anvisa. Como a iniciativa privada a velocidade de decisão seria mais rápida", espera.
A segunda-diretora da Anvisa acredita que o setor privado naturalmente terá acesso às vacinas. No entanto, ela nota que, no momento, há uma dificuldade mundial no abastecimento, com uma distribuição desigual entre os países.
"Há países vacinando adolescentes saudáveis e outros que ainda não conseguiram vacinar os profissionais de saúde", lamentou.
Laboratórios veterinários
Também respondendo a questionamento de General Peternelli, Meiruze informou que a Anvisa está acompanhando o processo de desenvolvimento de vacinas em laboratórios dedicados à imunização animal, com o objetivo de ampliar a produção nacional.
"Direcionamos as empresas para conseguir uma aprovação mais célere, com desfecho de vacina com qualidade e eficácia", comentou.
A segunda-diretora apontou para a necessidade de o Congresso aprovar a regulamentação para autorizar os laboratórios veterinários a fabricar vacinas contra a Covid-19 (PL 1343/21). A proposta foi aprovada pela Câmara na terça-feira e seguirá para análise do Senado Federal.
Meiruze afirmou que a transferência de tecnologia para produzir vacinas em laboratórios veterinários pode ser uma estratégia para o Brasil ter maior autonomia na produção de vacinas.
"Há muitas incertezas relacionadas a esta pandemia e a própria Organização Pan-Americana de Saúde vem alertando para necessidade de aumentar a produção para América do Sul e países em desenvolvimento."











ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.