Do laboratório até as farmácias leva até 15 anos: como nasce um remédio?
O remédio que você encontra na farmácia ou no postinho de saúde do seu bairro demorou muito tempo para chegar ali. E não falamos da logística de transporte.
Entre um cientista descobrir o que cura uma dor de cabeça e esse medicamento estar disponível no mercado, pelo menos dez anos de estudos foram necessários. Às vezes, 15.
A demora é justificada, em partes, pelo criterioso método científico, a fim de garantir que o remédio seja o mais seguro e eficaz possível. Mas não basta dizer que ele funciona. Existem órgãos regulatórios que precisam analisar tudo o que foi estudado sobre aquele composto para bater o martelo: aprovado!
É possível que esse processo seja menos demorado, graças aos avanços da tecnologia e do conhecimento que permitem investigações mais rápidas e simultâneas. Mas, ainda assim, é um tempo considerável.
Além disso, dificuldades financeiras e interesses econômicos criam um "vale da morte", como é chamado o momento em que a descoberta científica "morre" por falta de investimento.
O pesquisador pode entender que uma doença precisa ser tratada, mas essa doença, muitas vezes, não é de interesse comercial de uma indústria, seja nacional ou multinacional. Marco Antonio Stephano, professor de ciências farmacêuticas da USP
Encontrando o alvo
Se no passado a descoberta de uma substância que matava bactérias se dava ao acaso, hoje é bem intencional. Nos laboratórios das universidades e das indústrias farmacêuticas, cientistas buscam alvos terapêuticos, que geralmente são proteínas que não estão funcionando bem no organismo e provocam doenças.
"A gente precisa primeiramente ter informação da biologia por trás da doença", explica Micael Cunha, pesquisador de pós-doutorado no CQMED (Centro de Química Medicinal) da Unicamp.
Muitas perguntas são feitas: o que provoca a febre? Uma infecção. Por bactéria ou vírus? Bactéria: bingo! O que essa bactéria faz no corpo?
No CQMED são estudadas proteínas envolvidas em quase todos os processos celulares. Desvendá-las pode ajudar a combater inflamações, infecções e tumores. Os cientistas também investigam alvos de leishmaniose, infecções bacterianas, desenvolvimento neurológico, cânceres e doenças metabólicas.
Já no LaSOM (Laboratório de Síntese Orgânica Medicinal), da UFPE, há pesquisas com enzima ligada ao controle da glicose no diabetes tipo 2, outra que pode tratar hipertensão e uma que visa matar o mosquito da dengue. Outras formas de tratar cânceres também são estudadas, como um implante que libera a medicação aos poucos.
Em busca da molécula perfeita
Identificado o alvo terapêutico, é hora de buscar uma solução, uma molécula que vai se encaixar perfeitamente nele e impedir o problema. O futuro remédio é, basicamente, essa molécula inicial.
Com base na literatura científica, nas classes de medicamentos e no alvo encontrado, os cientistas já têm ideia com quais tipos de moléculas podem trabalhar. A partir daí, alguns caminhos são:
- Analisar bibliotecas comerciais: é como uma biblioteca de livros virtual, mas com compostos químicos. Numa seleção de 1 milhão de moléculas, os cientistas testam com a proteína --o alvo terapêutico-- e compram a que deu match.
- Criar a molécula do zero: esse é o foco do LaSOM, da UFPE, coordenado por Janaina Anjos. Sabendo a estrutura tridimensional da proteína, os pesquisadores montam as moléculas com o encaixe adequado. A produção pode ter até dez etapas.
Nossa vantagem é que podemos ter um bom índice de acerto, porque estamos fazendo a molécula mais personalizada. Janaina Anjos, coordenadora do LaSOM da UFPE
No computador, é possível gerar compostos tridimensionais e ver se eles se encaixam na proteína. Se sim, a molécula é fabricada no laboratório ou por uma empresa para ser testada e ver se o experimento feito computacionalmente é válido.
Encontrada uma molécula que se liga ao alvo, mais testes são realizados para verificar como e se dá o resultado esperado e se é potente o suficiente. É a chamada prova de mecanismo.
A combinação também é testada em células ou bactérias para avaliar se há reações indesejadas, como ação tóxica. Nesse processo, que pode levar de três a seis anos, as moléculas podem ser modificadas e outras avaliadas para se chegar ao modelo adequado.
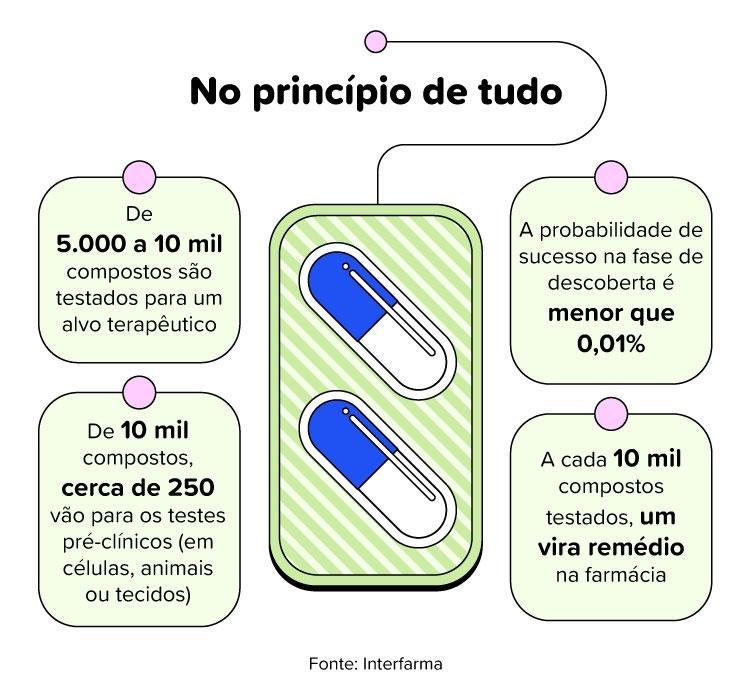
Testes em animais são necessários, mas há alternativas
Se a molécula tiver bons resultados em células, sem toxicidade, ela precisa ser testada em um organismo vivo. Camundongos são escolhidos por alguns motivos:
- São pequenos, dóceis e mais fáceis de manter e estudar dentro de um laboratório;
- Há similaridade genética com o ser humano;
- O ciclo de vida relativamente curto implica em resultados mais rápidos;
- O genoma pode ser facilmente manipulado.
Os animais podem ser saudáveis, mas se um remédio para diabetes está em teste, é preciso simular a doença no animal. O objetivo da pesquisa também define a necessidade de testes em não roedores, como macacos e porcos.
75% dos novos medicamentos são reprovados na fase dos testes toxicológicos em animais.
No Brasil, o Concea (Conselho Nacional de Controle dos Experimentos Animais) formula e regulamenta a legislação sobre o uso correto de animais em pesquisa e ensino. Há diretrizes sobre manejo geral, eutanásia e princípios de ética e integridade. O país também é signatário de legislações internacionais acerca do tema.
O Concea ainda monitora a introdução de métodos alternativos ao uso de animais, o que não significa necessariamente a ausência deles.
"Pode ser substituição total, redução ou refinamento, de aumentar a analgesia para que esse animal tenha um uso bastante humanitário e bem-estar na hora da utilização", explica Kátia De Angelis, coordenadora do Concea. Segundo o órgão, a redução pode chegar a 60%.
"Se é medicamento oral, já existem diretrizes que diminuem o número de animais. Se o medicamento é injetável, tenho que fazer os testes preconizados, em que o desfecho é a morte do animal", diz Marco Antonio Stephano, também do Concea.
'Vale da morte' separa pesquisa do remédio na prateleira
"A gente não sabe se os novos candidatos a fármacos vão ser testados. A gente tem esse sonho, mas não sabe se um dia vai acontecer", diz Janaina Anjos, da UFPE.
Apesar do esforço, nem toda molécula testada e aprovada nos laboratórios das universidades vira remédio na prateleira da farmácia. Acabam parando no "vale da morte", etapa em que muitos projetos de pesquisa científica não vão pra frente por falta de incentivo financeiro.
Os pesquisadores relatam ausência de interesse da indústria farmacêutica em investir na produção do fármaco para a etapa seguinte, que são os testes em humanos.
Também falam da pouca conexão entre universidades e empresas: enquanto os cientistas não sabem do que o mercado precisa, o mercado não sabe o que os cientistas estão fazendo.
"Nós fazemos estudos dentro das universidades, mas para tirar esse produto de lá, precisamos de um financiamento de US$ 300 mil a US$ 1 bilhão. Se a empresa farmacêutica não vê isso como investimento, que pode dar lucro, ela não vai investir", diz Stephano.
Buscam-se voluntários!
Quando uma descoberta científica encontra viabilidade econômica, o próximo passo é estudar como o remédio age em seres humanos, com voluntários que se inscrevem ou são chamados a participar da pesquisa.
Para isso, a empresa deve ter aprovação regulatória da Anvisa e ética da Conep (Comissão Nacional de Ética em Pesquisa). A empresa deve apresentar:
- DDCM (Dossiê de Desenvolvimento Clínico de Medicamento): traz todas as informações dos testes em animais, da qualidade do produto, como ele é fabricado, qual o princípio ativo e os demais ingredientes do remédio.
- Proposta de desenvolvimento: detalha todos os estudos que serão feitos.
É raro, mas a pesquisa clínica pode não ser autorizada se as informações estiverem incompletas ou se a agência concluir que os riscos são maiores do que os benefícios.
Dividida em três fases, cada uma com um objetivo, a pesquisa clínica pode durar de seis a nove anos. O tempo pode reduzir se as etapas se fundirem —como ocorreu no desenvolvimento de vacinas para a covid— ou se o medicamento é para uma doença rara, por exemplo.
Lembrando que menor tempo não significa menor confiabilidade. Tudo é feito com o devido rigor técnico, regulatório e científico.
A regra geral é fazer um desenvolvimento clínico mais devagar, subir um degrau de cada vez, primando sempre pela segurança dos voluntários da pesquisa e dos pacientes que estão sendo submetidos a esse tratamento experimental. Isabella do Carmo Gomes, gerente de avaliação de segurança e eficácia da Anvisa
A Anvisa só libera a etapa seguinte se os resultados da fase anterior atingirem os objetivos e for seguro. O órgão pode requerer mais investigações naquele estágio, o que pode prolongar o tempo de pesquisa.
Em 2022, a Anvisa recebeu 308 pedidos de estudos clínicos, dos quais 282 foram autorizados. No ano passado, foram autorizados 280 ensaios clínicos. Até 26 de abril deste ano, 66 estudos clínicos foram autorizados.
Tipos de medicamentos
- Medicamento de referência: É o remédio original, com marca, que passou pelos testes de eficácia e segurança em animais e seres humanos. A empresa fabricante tem o direito de comercialização exclusiva até cair a patente do laboratório, que tem validade de 20 anos no Brasil.
- Medicamento genérico: Sem marca, tem o mesmo princípio ativo do medicamento de referência e a mesma dosagem. Ele só passa por testes de equivalência farmacêutica e bioequivalência para garantir que seu efeito é o mesmo do original.
- Medicamento similar: Também é baseado no remédio de referência e deve passar pelos mesmos testes que o genérico, mas carrega um nome de marca.
Registro é concedido na maioria das vezes
Depois que os estudos com humanos atestam que o medicamento funciona e é seguro, a empresa interessada em comercializar o produto deve solicitar o registro dele à Anvisa.
Além das provas de segurança e eficácia, a companhia deve apresentar informações de qualidade que incluem:
- Como o medicamento será produzido
- Em que planta industrial será fabricado
- Onde o princípio ativo e demais ingredientes serão comprados
- Quais informações irão na embalagem do remédio
- Qual material será utilizado na embalagem
- Certificação de boas práticas de fabricação
- Plano de monitoramento do produto depois que ele for disponibilizado ao mercado
Qualquer falha nessas informações pode levar ao não consentimento do registro ou a um registro condicional. Neste caso, a empresa se compromete a conduzir estudos complementares ou coletar dados adicionais.
Isabella do Carmo Gomes, da Anvisa, destaca que o registro é concedido mediante avaliação de risco e benefício para uma condição, população e uso determinados. "Um medicamento ser seguro para qualquer condição de uso não existe."
O tempo médio de aprovação da agência é em torno de dois anos, prazo que varia conforme complexidade ou norma de priorização. Segundo ela, pelo menos quatro pessoas se envolvem em toda a análise dos documentos.
Em 2022, a Anvisa aprovou 576 novos medicamentos, incluindo biológicos. No ano passado, foram 282 aprovações de registros de medicamentos e de autorizações de produtos de cannabis.
O preço da sua saúde
Após a aprovação da Anvisa, a empresa deve solicitar o registro de preço do remédio à CMED (Câmara de Regulação do Mercado de Medicamentos). O órgão é formado por um conselho de ministros que analisa e estabelece o preço máximo que um medicamento pode ser vendido no Brasil.
A determinação é feita para empresas produtoras, importadoras e distribuidoras (preço de fábrica, ou PF) e para farmácias e drogarias (preço máximo ao consumidor, ou PMC). No Brasil, a política que instituiu os medicamentos genéricos prevê que eles sejam, no mínimo, 35% mais baratos do que o de referência.
A definição do preço considera critérios como:
- Se o medicamento é inovador e traz benefício superior aos já utilizados para aquela condição
- Se é inovador, mas sem benefícios clínicos superiores
- Se o remédio é fruto da combinação de diferentes princípios ativos já existentes
- Se é uma nova apresentação de um remédio já comercializado
- Se possui patente e traz ganho terapêutico
- Tipo de medicamento
- Custo-efetividade
- Preços já praticados no país
Com o preço máximo estabelecido, as empresas podem ajustar os valores dentro de um intervalo definido, considerando também práticas de descontos. Clique aqui e consulte a lista de preços.
A CMED informa que também "adota regras que estimulam a concorrência no setor, monitora a comercialização e aplica penalidades quando suas regras são descumpridas".
O medicamento entra primeiro no mercado privado. Para ser disponibilizado pelo SUS, é preciso uma avaliação da Conitec (Comissão Nacional de Incorporação de Tecnologias), do Ministério da Saúde. Nesse ponto, a Anvisa não tem gestão.
Fonte adicional: Daniela Pazzetto Luize Pizzi, coordenadora de desenvolvimento de produtos da Medley
Referências
6ª edição do Anuário Estatístico do Mercado Farmacêutico
https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/medicamentos/cmed/anuario-estatistico-2022
Alexander Fleming and the discovery of penicillin
https://www.scielo.br/j/jbpml/a/jY6NfbwqjkMQTbCdFBRbp4M/?lang=en&format=pdf
Introduction: historical perspective and development of amoxicillin/clavulanate
https://www.sciencedirect.com/science/article/abs/pii/S0924857907003408?via%3Dihub
Avaliação comparativa do perfil de dissolução in vitro de microgrânulos gastrorresistentes de omeprazol de diferentes fabricantes para desenvolvimento de medicamento similar
https://www.arca.fiocruz.br/bitstream/handle/icict/14557/1.pdf;jsessionid=8D4CC045977EEC11277C1FCE222AD40B?sequence=3
Omeprazol sódico: caracterização das propriedades físico-químicas e desenvolvimento de comprimidos gastro-resistentes
https://repositorio.ufsc.br/bitstream/handle/123456789/92635/263783.pdf?sequence=1&isAllowed=y
American Chemical Society - Losartan
https://www.acs.org/molecule-of-the-week/archive/l/losartan.html
Fifteen years of losartan: what have we learned about losartan that can benefit chronic kidney disease patients?
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3108782/
Que Bobagem! Pseudociências e Outros Absurdos Que Não Merecem Ser Levados a Sério. Carlos Orsi, Natalia Pasternak. Editora Contexto, 2023.














7 comentários
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Leia as Regras de Uso do UOL.
Alexandre Rodrigues da Silva
E queriam que tomássemos vachina feita em menos de 1 ano. Vai entender.....
Fernando Augusto Dias
Em compensação existem remédios em anúncios na TV, que curam de calo até queda de cabelos, e que são lançados de imediato.
Valéria Turbuk Garran
Dados antigos, parece uma reportagem de 2014 em 2024. Que tal falar de vacinas COVID, de ZOlgesma. Esse cenario descrito mudou muito.