O que é necessário para uma vacina ser aprovada para uso humano?
Receba os novos posts desta coluna no seu e-mail
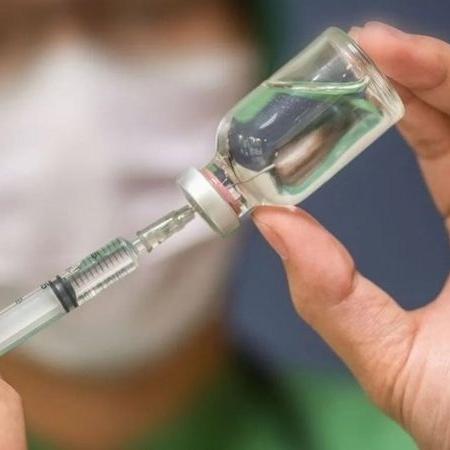
Nessas últimas semanas, algumas empresas divulgaram os resultados de suas pesquisas para a produção de uma vacina contra o novo coronavírus. Como não poderia ser diferente, a informação de que essas imunizações tiveram eficácia de mais de 90% para proteger contra a covid-19 animou muita gente e aumentou a esperança de que em breve teremos uma ou mais vacinas licenciadas para uso humano em larga escala.
E com tantos resultados positivos divulgados pelas empresas é normal surgir a seguinte dúvida: o que é necessário para que essas vacinas sejam logo aprovadas, a população receba a proteção e a pandemia acabe?
Primeiro, precisamos entender que na ciência existem protocolos rígidos para garantir que uma vacina seja eficiente e segura ao ser licenciada para uso humano. E esses protocolos não são definidos por um ou alguns cientistas. Todos os requisitos contidos em quaisquer diretrizes para se desenvolver uma vacina e aprová-la precisam seguir recomendações de importantes organizações de saúde, como, principalmente, a OMS (Organização Mundial da Saúde), a FDA (Food and Drug Administration), nos Estados Unidos, ou Anvisa (Agência Nacional de Vigilância Sanitária), aqui no Brasil. Vou tentar explicar simplificadamente algumas dessas recomendações a seguir.
1. Ser para todas as idades
Primeiramente, quando falamos de uma doença global que gerou uma pandemia, é necessário que as vacinas possam ser aplicadas em pessoas de todas as idades e, inclusive, sejam adequadas para administração em mulheres grávidas e lactantes, assim como em pessoas imunocomprometidas (em tratamento de câncer, com HIV, transplantados etc.). Mas claro que, caso alguma das vacinas tenha contraindicações, ela não deixará de ser aprovada, mas será levado ao público todas as contraindicações e o porquê de ela não poder ser usada em determinados grupos.
2. Só gerar efeitos adversos leves
Além de ter boa eficácia, a imunização precisa ser segura. Isto é: gerar apenas eventos adversos leves e transitórios relacionados à vacinação, e nenhum caso grave. Mas ninguém vai deixar de tomar uma vacina para se proteger contra a covid-19 caso ela provoque leves dores de cabeça ou até febre, contanto que sejam problemas passageiros e tratados com medicamentos de uso comum.
3. Ter eficácia de ao menos 50% e proteger por ao menos 6 meses
Um dos pontos mais importantes e que tem levado uma disputa alucinante nos últimos dias é o nível de proteção de uma vacina. A eficácia da vacina contra a covid-19 deveria ser de pelo menos 70%. Porém, com as pressões internacionais, hoje é aceita uma vacina com clara eficácia de no mínimo 50%. E essa proteção não pode ser apenas em curto prazo. O ideal é que ela confira proteção por pelo menos um ano. Só que aí tem outro porém devido a pressões internacionais: hoje já é aceita uma vacina que confira proteção por no mínimo seis meses.
É importante que uma vacina proteja por um "longo período" pois não seria possível ficar vacinando uma população a cada três meses, por exemplo. Antes de terminar uma campanha, teríamos que começar outra. Ou seja, o mundo viraria uma eterna campanha de vacinação contra a covid-19.
Entende agora por que não podemos levar uma vacina ao público com poucos meses de testes? Requer tempo para ter esses dados supracitados —como saberemos se a proteção dura um ano se o teste durou três meses, por exemplo?
4. Ter no máximo duas doses
É importante que as vacinas gerem a proteção com no máximo duas doses. Isso porque, se forem muitas doses, além da necessidade de se produzir um número maior de vacinas para imunizar toda a população, pode acontecer de as pessoas não seguirem corretamente à vacinação e não tomarem todas as doses —sem falar da dificuldade de organizar as campanhas.
5. Ter estabilidade e fácil armazenamento
Outro ponto de extrema importância para aprovar a vacina é sua logística de aplicação. Quanto menos a imunização necessitar de condições de temperatura muito baixa, melhor será sua distribuição de forma global. Imagine que uma vacina precise ser armazenada a -70°C e não resista por muito tempo em temperaturas entre 2 a 8 °C? A aplicabilidade dela será restrita a locais com alto padrão em infraestrutura.
Dessa forma, uma vacina pode ser armazenada em temperaturas de -20 a -70 °C com longo prazo de validade, por exemplo um ano, mas precisa demonstrar estabilidade, ou seja, não se degradar rapidamente quando estiver em temperatura de 2 a 8 ° C por pelo menos duas semanas, para que seja conduzida e aplicada em lugares mais distantes dos grandes centros.
6. Ser avaliada por uma equipe sem interesses
Mesmo que uma vacina atenda a todos os pontos citados acima para ser liberada para uso humano, isso só acontece após as empresas, universidades e/ou centros de pesquisa mandarem todos os dados originais para análise por um corpo técnico especializado neste assunto e independente, que não tenha conflito de interesses.
Esses dados têm informações desde a forma que foi preparada a vacina até a maneira que foi feita a análise estatística dos dados coletados dos pacientes, ou seja, tudo de forma detalhada. Então, esses números que aparecem agora de 90%, 92%, 94.5%, 95% de proteção de uma vacina podem mudar drasticamente após uma análise real. Só então a vacina será licenciada e segura para população, pois a equipe que avaliará os dados terá total isenção e seguirá todas as normas que a ciência estabelece.














ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.