26 estudos testam plasma convalescente para tratamento de covid no Brasil
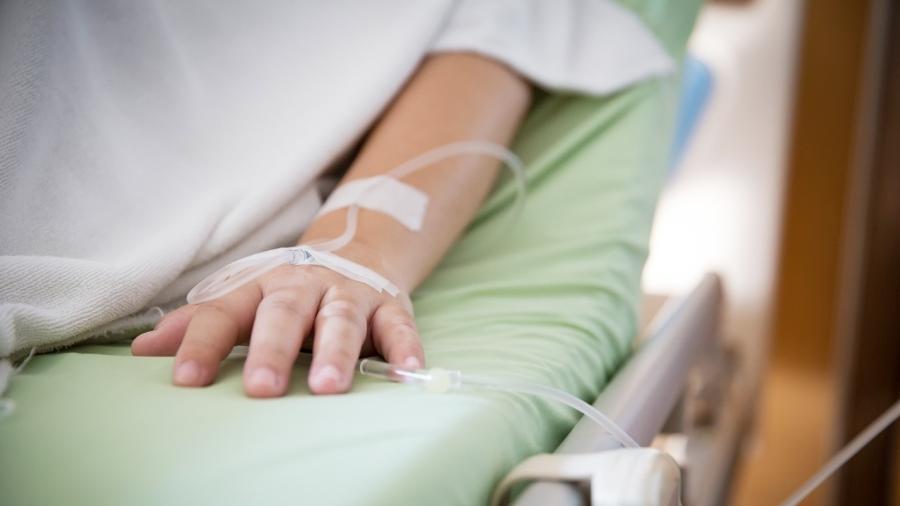
A transfusão de plasma sanguíneo de recuperados da covid-19 em doentes na fase aguda da infecção é foco de ao menos 26 estudos clínicos no Brasil, a maioria não concluída ou com resultados ainda inconclusivos.
O tratamento ganhou destaque no domingo, após a FDA, agência americana de medicamentos, autorizar o uso emergencial da terapia em meio à pressão do presidente Donald Trump, que defende a eficácia do método mesmo sem evidências científicas robustas.
Para cientistas brasileiros envolvidos em pesquisas sobre o tema, resultados dos primeiros estudos no Brasil e no mundo mostram que a terapia é segura e promissora — mas, por limitações na metodologia das pesquisas ou número pequeno de participantes, nenhuma delas permite afirmar que o tratamento, de fato, reduz significativamente o risco de morte por covid.
Einstein e Sírio
As primeiras instituições brasileiras a investigarem o uso de plasma convalescente contra covid foram os Hospitais Albert Einstein e Sírio-Libanês. Na primeira fase da pesquisa, feita conjuntamente pelas duas instituições e já finalizada, 60 pacientes receberam o composto sanguíneo.
Em uma segunda fase, ainda em andamento, outros 60 doentes farão uso da terapia, mas todos deverão cumprir o requisito de não estarem entubados para que a terapia seja avaliada antes de um agravamento maior do quadro.
"Os resultados são claros quanto à segurança. É uma terapia segura. E há uma indicação de efetividade, principalmente se o plasma é dado nos primeiros dias da infecção. Mas não tivemos grupo controle. Esses resultados podem não se confirmar em estudo randomizado e controlado", diz Luiz Vicente Rizzo, diretor-superintendente de pesquisa do Einstein.
Ele refere-se a estudos em que são incluídos, além dos pacientes que fazem uso da medicação em teste, doentes que recebem placebo - o chamado grupo controle. Só assim é possível comparar diretamente os resultados de quem tomou e de quem não recebeu a terapia e, assim, minimizar o risco de os resultados encontrados terem ocorrido por acaso. É importante ainda que os participantes de cada grupo sejam escolhidos aleatoriamente (de forma randomizada).
O principal estudo feito nos Estados Unidos até agora e citado por Trump no domingo para justificar a autorização do uso emergencial também não teve grupo controle.
Mais estudos
No Brasil, o Hospital das Clínicas da Faculdade de Medicina da USP (FMUSP) iniciou em junho um estudo randomizado e controlado com o uso de plasma convalescente.
"Serão 120 pacientes divididos em três grupos: um recebe placebo, outro recebe plasma em maior volume e outro, em menor volume. Já foram incluídos 73 pacientes. As primeiras análises dos 30 primeiros confirmam que é uma intervenção segura, mas a amostra é muito pequena para confirmar o benefício. Temos de esperar", explica Esper Kallás, coordenador do estudo e professor da FMUSP.
A pesquisa, diz ele, deve terminar a inclusão de pacientes nas próximas semanas. Ela é financiada pelo Ministério da Ciência, Tecnologia e Inovações (MCTI).
Nesta segunda-feira, 24, a OMS ressaltou que os estudos clínicos finalizados até agora têm resultados "inconclusivos" e afirmou que irá esperar o término de ensaios clínicos randomizados e controlados para fazer qualquer recomendação a respeito.
Limitações
O uso de plasma convalescente já acontece há mais de cem anos contra outras doenças infecciosas. Ele foi investigado em epidemias mais recentes, como as de SARS, MERS e Ebola e, embora dados preliminares tenham demonstrado benefícios clínicos, estudos mais aprofundados não tiveram continuidade quando tais surtos arrefeceram.
A terapia, apesar de antiga, é cara e complexa do ponto de vista das análises que precisam ser feitas na amostra antes da transfusão.
"Além dos testes já padronizados para doação de sangue, como o de HIV e tipagem sanguínea, é preciso fazer pesquisa de anticorpos específicos para o coronavírus e verificar a quantidade. Não são todas as pessoas que produzem anticorpos em níveis suficientes para que possamos utilizar em outro doente", explica Bruno Deltreggia Benites, hematologista e hemoterapeuta do Hemocentro da Unicamp, uma das instituições que participa da pesquisa da USP.
Os especialistas explicam que é recomendável ainda submeter o plasma coletado a um teste para um anticorpo específico (o anti-HLA), mais presente em mulheres que já tiveram filhos. Esse anticorpo pode provocar uma reação rara no receptor, que leva a uma lesão no pulmão - por isso a pesquisa do anticorpo é necessária.
De acordo com Rizzo, o custo do procedimento é outro desafio. "A cada 30 pacientes transfundidos com plasma, gastamos R$ 1,7 milhão. Tem o custo da bolsa, dos testes feitos na amostra para várias doenças, de trazer o doador", ressalta o diretor do Einstein.
Para Benites, a autorização para uso do plasma mesmo sem evidências mais fortes, como ocorreu nos EUA, pode prejudicar até o andamento dos estudos clínicos. "A gente precisa de grupo controle. Nos Estados Unidos, já há a dificuldade de incluir pessoas nos estudos porque ninguém quer correr o risco de cair nesse grupo. Mas temos de lembrar que é um tratamento experimental", diz.
As informações são do jornal O Estado de S. Paulo.













ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.